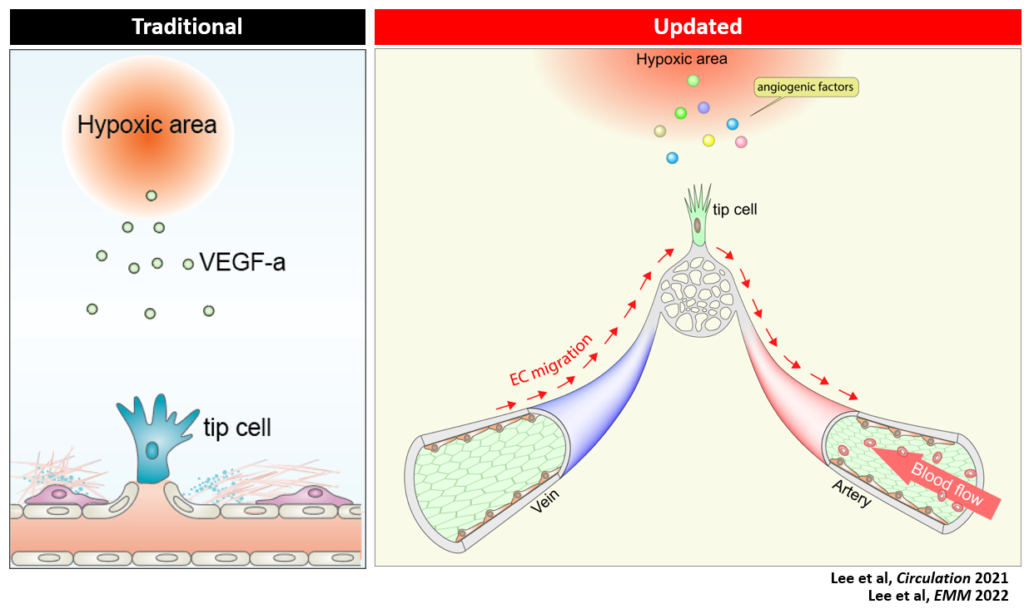
전통적 혈관신생 모델은 저산소지역에서 합성된 VEGF (혈관생성인자)가 기존의 혈관을 자극하여 저산소지역으로 혈관의 이동 및 침투를 촉진시킨다는 VEGF 신호전달 기전 중심의 모델이었습니다. 이러한 지식을 기반으로 VEGF 신호전달 기전의 조절하는 anti-VEGF therapy 약물들은 항암제로서는 많은 기대를 받았고 수많은 약물들이 FDA의 허가를 받아 임상에 적용이 되었습니다.
하지만 이러한 모델은 기존의 수많은 anti-VEGF therapy의 낮은 효과와 내성, 그리고 잦은 재발로 인해 도전을 받고 있습니다. 왜 혈관신생에 가장 중요한 분자로 알려졌던 VEGF를 저해하는 anti-VEGF therapy는 과학자들의 기대치를 충족하지 못했을까요?
최근 저희 그룹에서는 혈관신생은 정맥내피세포가 전구체로서, 모든 혈관내피세포의 기원세포가 된다는 것을 밝혀내었습니다. 이는 정맥내피세포가 혈류에 역행을 하여 다른 내피세포로 분화됨을 의미하고, 정맥내피세포가 새로운 혈관생성 저해의 표적이 될 수 있다는 가능성을 제시합니다.
본 실험실에서는 직접 제작한 다양한 유전자변형 마우스를 사용하여 신혈관신생의 메커니즘을 밝혀내고 이를 바탕으로 새로운 바이오 신약개발에 몰두하고 있습니다.